Пептидний зв'язок являє собою ковалентную зв'язок, яка встановлюється між двома молекулами, коли карбоксильна група одного реагує з аміногрупою іншої за допомогою реакції конденсації (або дегідратації, що призводить - тобто - до усунення молекули води). ).
Зазвичай пептидний зв'язок утворюється між двома амінокислотами, що походять з дипептида.
Оскільки в його молекулі дипептид все ще містить аміногрупу і карбоксильну, вона може утворювати пептидний зв'язок з третьою амінокислотою, що походить з трипептиду, і так далі. Коли кількість амінокислот відносно невелике, його називають олигопептидом, тоді як якщо кількість амінокислот збільшується, то його називають поліпептидом або білком.
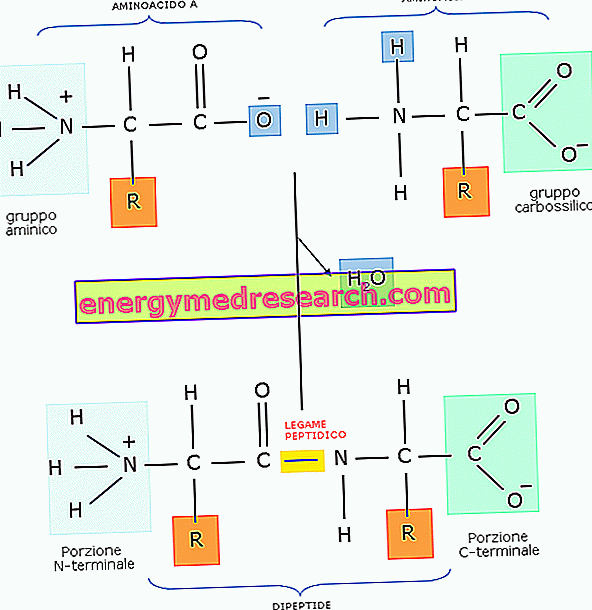
Насправді, незважаючи на фігуру, пептидний зв'язок не є простим, але представляє для 60% єдину природу зв'язування і для 40% природу подвійного зв'язку.
У живих організмах утворення пептидного зв'язку каталізується ферментом, який називається пептидилтрансфераза - присутній в основній субодиниці рибосом.
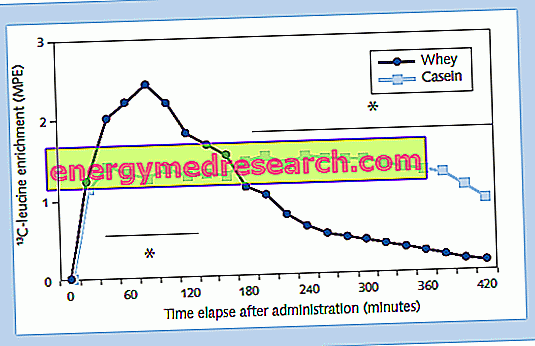
Навіть введені в раціон білки складаються з ланцюгів амінокислот, з'єднаних пептидними зв'язками. Під час травлення ці зв'язки розриваються певними ферментами (пептидазами), присутніми в соках шлунка і підшлункової залози. Одні амінокислоти, колись поглинаються кишечником, проходять з крові і підхоплюються клітинами - передусім печінковими - які об'єднують їх через нові пептидні зв'язки для формування необхідних білків (не тільки структурних, але й гормональних, ферментативних і т.д. .). У природі, по суті, існує велика кількість білків, з різними фізико-хімічними характеристиками, які випливають з різних властивостей 20 звичайних амінокислот і від того, як вони об'єднуються в поліпептидного ланцюга. Досить сказати, що білок 100 амінокислот, тому відносно невеликий, може складатися з 20100 = 1, 27 x 10130 можливих поліпептидних ланцюгів. Інструкції для побудови правильного амінокислотного ланцюга укладені в геном індивідуума.