міозин
Міозин - двигун міофібрил; кожна молекула складається з 6 субодиниць, з яких 2 ідентичні важкі ланцюги, дуже великі, і дві пари менших легких ланцюгів.
Важкі білкові ланцюги переплітаються, утворюючи кінцевий хвіст, жорсткі, спіральні і дві кулясті голови.
Два легких білкових ланцюга пов'язані з важкими ланцюгами кожної голови.

У товстих нитках різні ізоформи міозину організовуються таким чином, щоб виставляти свої голови на кінцівки, а хвости згруповані у вигляді пучка в центральній області. Стик між головою і хвостом є гнучкою шийкою (шарніром), що дозволяє головам згинатися під час скорочення.
Глобулярна частина також називається важким мероміозином, тоді як кінцева частина відома як легкий мероміозин.
Міозинові глобулярні головки утворюють поперечні мости, які опосередковують взаємодію з тонкими нитками актину, які діють як "канат".
Явище скорочення можна розділити на дві фази:
1) зчеплення (формування поперечних містків) між товстими і тонкими нитками;
2) розсувні нитки
Як зазначалося, утворення поперечних містків залежить від збільшення активності кальцію всередині волокна. Присутність в голівці міозину кишені, призначеної для зв'язування з АТФ, є також фундаментальним, так само як і ферменту (АТФази), здатного розщеплювати його на АДФ і неорганічний фосфат, вивільняючи енергію.
актин
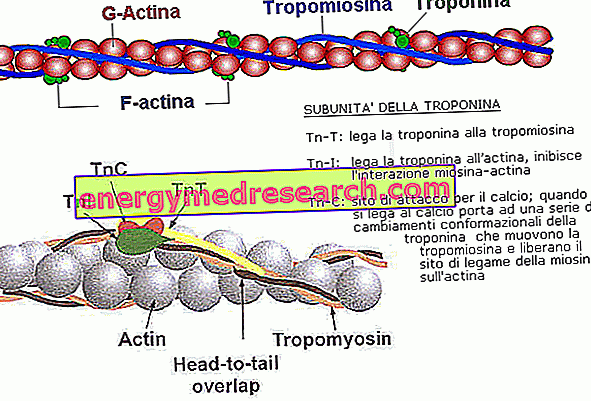
Актін, який утворює дрібні нитки саркомера, являє собою глобулярний білок, подібний за формою до сфери (G-актин). Багато з цих молекул пов'язані один з одним, щоб складати довгі і тонкі гранули (звані F-актин). Дві з цих ланцюжків обертаються один над одним, як дві намисто з перлів, що дає початок тонкій нитці.
Кожна молекула G-актину містить сайт зв'язування для голови міозину, який в умовах спокою фактично блокується двома білками. Тонкі нитки фактично складаються не тільки від актину, а й від:
- ТРОПОМІОЗІН: у спокійному м'язі він запобігає контакту між 7 молекулами G-актину та їхніми головами міозину, підтримуючи розслаблення м'язів.
- ТРОПОНІН: коли він зв'язує кальцій, він змінює свою конформацію і переміщує тропоміозин, що дозволяє зв'язуватися з міозином
Крім цих білків, м'язові міофібрили містять інші, включаючи:
титін, з'єднаннян і небулін, з функцією стабілізації і центрування саркомера під час скорочення.



