Що таке інсулін
Інсулін є гормоном білкової природи, продукованим групами клітин підшлункової залози, що називається «β-клітинами острівців Лангерганса». Його відкрив у 1921 році англієць Джон Джеймс Маклеод і канадський Фредерік Грант Бейтінг, Нобелівська премія з медицини в 1923 році.
функції
Інсулін є анаболічним гормоном par excellence, фактично через його дію:
- полегшує проходження глюкози з крові до клітин і тому має гіпоглікемічну дію (знижує рівень цукру в крові). Сприяє накопиченню глюкози у вигляді глікогену (глікогеносинтез) в печінці і пригнічує деградацію глікогену до глюкози (глікогенолізу).
- Це полегшує проходження амінокислот з крові до клітин, має анаболічну функцію, оскільки стимулює синтез білка і пригнічує неоглукогенез (утворення глюкози, починаючи з деяких амінокислот).
- Це полегшує проходження жирних кислот з крові в клітини, стимулює синтез жирних кислот, починаючи з глюкози і надлишку амінокислот і пригнічує ліполіз (утилізація жирних кислот в енергетичних цілях).
- Полегшує проходження калію в клітини.
- Стимулює проліферацію клітин.
- Стимулює використання глюкози для виробництва енергії.
- Стимулює ендогенну продукцію холестерину.
Найбільший стимул для дії інсуліну надається їжею, багатою простими вуглеводами і низьким вмістом клітковини, жиру та білка. Також деякі препарати (сульфонілсечовини) здатні збільшувати свою секрецію.
Insights
Інсулін і спортІнсулін і допінгГлікемія і схудненняДіабетІнсулінорезистентність гіперінсулінемія Швидкий інсулін і повільний інсулін \ tрезюме
Проінсулін є біосинтетичним попередником інсуліну. Існує також пре-про-інсулін, який порівняно з проінсуліном має послідовність амінокислот, яка діє як сигнал для його транспорту, спочатку в ретикулоендоплазми, а потім у Гольджи, де вона досягає правильної конформації.
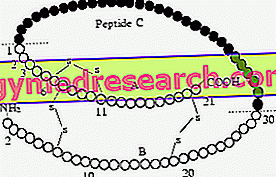
Інсулін вивільняється як глобулярний поліпептидний білок ланцюга, унікальний для полирибосом; згодом гормон осаджують у вигляді гранул, що досягають кристалічної форми, видимі під електронним мікроскопом. Зі збільшенням концентрації інсулін агрегується в димери (пара мономерів, що утримуються разом слабкими зв'язками) і димери або тримери гексамерів (утримуються двома центральними іонами Zaco, які координуються з 3 тирозинами димерів і трьома молекулами H2O ).
Як тільки інсулін вивантажується в циркуляційний потік, розбавленням він переходить у димерну і мономерну форму, остання розпізнається рецептором інсуліну.
Деякі дослідники відзначають, що в людському інсуліні існують варіабельні області, зокрема амінокислотна послідовність n ° 28 і 29 (Pro-Lys) ланцюга β; згодом було виявлено, що реверсування цих АА інсуліну передається безпосередньо в монометричне стан, пропускаючи димерний. Так народився "Lys Pro" або "швидкий інсулін", препарат особливо корисний, якщо його вводять поблизу великої їжі.
Механізм дій
Рецептор інсуліну являє собою трансмембранний глікопротеїн, що складається з 4-х ланцюгів (2α зовнішніх по відношенню до клітини і 2β внутрішньої клітини), з'єднаних спільно сульфідними мостами. Молекула має досить короткий період напіврозпаду і тому піддається швидкому обороту. Він теж синтезується як попередник шорсткою ендоплазматичною сіткою і потім обробляється в Гольджі. 2 α-ланцюга багаті цистеїнами, в той час як β багаті на гідрофобні АА, які прикріплюють їх до клітинної мембрани, і тироксин, що стоїть перед внутрішньою частиною цитозолу.
Зв'язування з рецептором інсуліну стимулює активність тирозинкінази і призводить до витрати 1 АТФ на фосфорильований тирозин. Це викликає ряд ланцюгових подій (активація білків G-фосфоліпази С), які призводять до утворення двох продуктів: DAG, який залишається прикріпленим до мембрани і втручається у фосфорилювання білків, і IP3, що діє на цитозольному рівні, дозволяє Вихід іону Са ++.
Коли рівень цукру в крові підвищується, збільшується кількість інсуліну, що виділяється клітинами підшлункової залози. У інсулінозалежних клітинах зв'язок інсулінового рецептора діє на внутрішньоклітинний пул везикул, звільняючи транспортер глюкози, який переноситься на мембрану шляхом злиття. Перенесення глюкози в клітку, викликаючи зниження рівня цукру в крові, що в свою чергу стимулює дисоціацію між інсуліном і його рецептором. Ця дисоціація ініціює процес аналогічного ендоцитозу, з яким носій повертається в везикули.
Діабет і інсулін
Термін діабет походить від грецького діабету і означає пройти через . Одним з характерних клінічних ознак цієї патології є наявність цукру в сечі, яка досягає вас через нирку, коли його концентрація в крові перевищує певну величину. Цей термін був пов'язаний з прикметником mellitus, тому що сеча, внаслідок присутності цукру, солодке і, в давнину, дегустація була єдиним способом діагностики захворювання
Цукровий діабет - це хронічне захворювання, яке характеризується гіперглікемією, тобто збільшенням цукрів (глюкози), наявних у крові. Це викликано зниженою секрецією INSULIN або поєднанням зниженої секреції і периферичного опору дії цього гормону.
У нормальних умовах інсулін, що виділяється підшлунковою залозою, надходить у кров, де він функціонує як "ключ", необхідний для отримання глюкози в клітини, яка, залежно від метаболічних потреб, використовуватиме її або зберігати як резерв. Це пояснює, чому дефіцит або змінена дія інсуліну супроводжується збільшенням циркулюючих цукрів, характерним для діабету.



