морфологія
На макроскопічному рівні у хвороби Альцгеймера можна спостерігати змінну ступінь атрофії кортикальної тканини (зменшення маси тканини або органу), що характеризується збільшенням тім'яних борозен, більш акцентованими в лобовій, скроневій і тім'яній частках. Ця атрофія компенсується збільшенням порожнин шлуночків вторинним до втрати паренхіми (фіг.1). Зокрема, в прогресивних стадіях захворювання, структури медіальної скроневої частки, включаючи гіпокамп, енторхінальну кору і мигдалину, атрофірують серйозно, враховуючи їх залучення, починаючи з ранніх стадій патології.
Крім того, хвороба Альцгеймера також має мікроскопічні зміни, відомі як позаклітинні старечі бляшки і внутрішньоклітинні нейрофібрилярні кластери, які є основою гістологічної діагностики. З прогресуванням захворювання спостерігається серйозна втрата нейронів, що супроводжується гліозом (обмежена або дифузна проліферація, що реагує в природі, клітини нейроглії, тобто клітини, які складають підтримуючу строму нервової тканини) в тих же регіонах. де наявність нейрофібрилярних бляшок і кластерів більша.
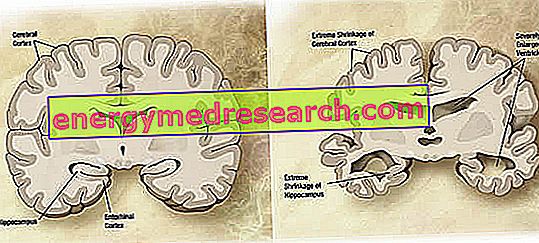
Рисунок 1. Корональний розріз головного мозку: відмінності між нормальним мозком і мозком, ураженими AD (джерело зображення Вікіпедії).
патогенез
Хвороба Альцгеймера характеризується головним чином двома типовими ураженнями: позаклітинним накопиченням старечих бляшок, що складаються в основному з β-амілоїдного пептиду (Αβ) і інтраневрональних нейрофібрилярних кластерів, утворених гиперфосфорилированним білком тау.
- Старечі бляшки можна знайти на рівні ділянок головного мозку, таких як гіпокамп, мигдалина і неокортекс.
Пептид Αβ походить від протеолітичного розрізу попередника амілоїдного білка (АРР), β-секретазою. Цей розріз генерує кінцевий карбоксильний фрагмент з 99 залишків (CTF або C99), який згодом розрізають β-секретазою з отриманням фрагментів Аβ, що мають різну довжину. Відомо, що найбільш поширеним видом Aβ є фрагмент Aβ40. Іншим відомим фрагментом, утвореним з протеолітичного розрізу, менш поширеним, ніж Аβ40, є Aβ42, більш схильний до утворення амілоїдних фібрил, які накопичуються у вигляді мозку Aβ у мозку людини з хворобою Альцгеймера.
- Інший компонент, присутній в хворобі Альцгеймера, представлений нейрофібрилярними кластерами, що складаються з пучків ниток, присутніх в цитоплазмі нейронів. Нейрофібрилярні кластери нерозчинні і, здається, стійкі до процесів протеолізу in vivo, залишаючись при цьому в зрізах тканини навіть протягом тривалого часу після смерті нейронів. Спостерігаючи за структурою, фібрилярні кластери складаються з подвійних спіральних ниток і лінійних ниток подібного складу. Аналізуючи композицію, нитки подвійної спіралі в основному виготовляють з гиперфосфорилированного тау білка. Тау являє собою аксональний білок, пов'язаний з мікротрубочками, що полегшує його збір.
Інші важливі невропатологічні зміни, присутні в хворобі Альцгеймера, включають мітохондріальну дисфункцію, пошкодження оксидативних нейронів, синаптичні втрати і дегенерацію аксонів.
Нейрохімічні аспекти
Як вже пояснювалося, пептид Αβ, що походить від протеолітичного розрізу попередника АРР, являє собою нейротоксичний компонент хвороби Альцгеймера . Зокрема, було висунуто гіпотезу про те, що Αβ може бути важливим для нормальних функцій мозку, і, якщо він долає певні концентрації, він може стати нейротоксичним. Крім того, як агрегати, так і різні ізоформи Αβ можуть мати різну біологічну, фізіологічну або патологічну роль, визначаючи і беручи участь у наступних стадіях захворювання. Було відмічено, що Αβ діє як нейромодулятор, впливаючи на вивільнення деяких нейротрансмітерів за відсутності явних ознак нейротоксичності.
Наприклад, нейромодуляторная роль Αβ у фізіологічному контексті може мати важливе значення для правильного балансу нейромедіаторної системи. Добре відомо, що ця система складається з нейротрансмітерів, речовин, що передають інформацію між клітинами, що складають нервову систему, нейрони, через синаптичну передачу.
У патологічних станах, з іншого боку, Aβ-опосередкована синаптична передача може бути пов'язана зі зміною нейротрансмісії до нейродегенеративних подій. Внаслідок цих змін можуть виникнути ранні когнітивні та не когнітивні розлади, засновані на уражених нейромедіаторних системах і різних ділянках мозку.
Зміни в нейромедіаторних системах і механізм сигнальної трансдукції в мозку осіб, які страждають хворобою Альцгеймера, дуже складні. Одна з систем, яка, як видається, змінена, стосується холінергічної сигнальної системи, яка включає нейромедіатор ацетилхолін. Дійсно, було показано, що індивідууми, які страждають хворобою Альцгеймера, показують знижену холінергічну передачу на рівні кори і гіпокампу, важливих областей мозку, присвячених таким явищам, як навчання і пам'ять. Крім цієї нейромедіаторної системи, при хворобі Альцгеймера спостерігалися зміни в норадренергічних, серотонінергічних, а також глутаматних і ГАМК-системах.



