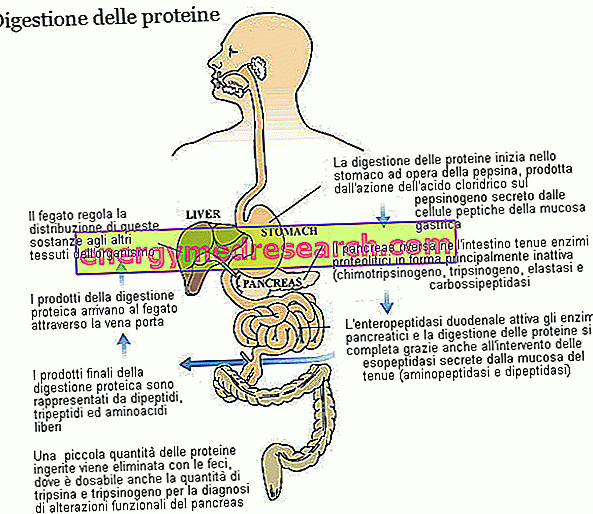
Трипсин і хімотрипсин є двома ключовими ферментами при перетравленні дієтичних білків. Обидва продукуються і секретуються як зимогени, тобто в неактивній формі, підшлунковою залозою; прекурсор зимогена трипсину називається трипсиногеном, тоді як хімотрипсин - хімотрипсиноген.
Трипсин і хімотрипсин належать до великої сім'ї протеолітичних ферментів (що беруть участь у перетравленні білків) і до підгрупи ендопептідаз. Ці речовини - включаючи пепсин шлунка і панкреатичну еластазу - атакують пептидні зв'язки всередині амінокислотного ланцюга, даючи початок меншим молекулярним фрагментам. Ферменти, що належать до другої групи, такі як екзопептидази, завершують роботу трипсину і хімотрипсину, відриваючи окремі амінокислоти від кінців пептидного ланцюга; Карбоксипептидази підшлункової залози (А1, А2 і В, які атакують карбоксильний кінець) відносяться до цієї сім'ї, а також амінопептидази (які атакують амінотермінальний кінець) і дипептидази, що продукуються і секретуються слизовою оболонкою тонкої кишки. Деякі карбоксипептидази, подібні до тих, що спостерігаються для трипсину (трипсиноген) і хімотрипсину (хімотрипсиноген), секретуються підшлунковою залозою в неактивній формі. У всіх трьох випадках ферментом, що бере участь у процесі ферментативної активації, є ентеропептидаза, білок, що продукується і секретується клітинами слизової оболонки дванадцятипалої кишки; більш конкретно, ентеропептидаза специфічна для трипсиногену, який після перетворення в трипсин також активує інші протеолітичні ферменти, включаючи сам трипсиноген.
Функціональні відмінності між трипсином і хімотрипсином просто стосуються їх специфічності, тобто здатності розпізнавати і розщеплювати тільки зв'язки, утворені добре визначеними амінокислотами. Трипсин втручається в основному на пептидні зв'язки, які залучають основні амінокислоти (такі як аргінін і лізин), тоді як хімотрипсин гідролізує переважно зв'язки, що включають тирозин, фенілаланін, триптофан, лейцин і метіонін.
Завдяки різноманітним протеолітичним ферментам, з внесенням кислотності шлунка, дієтичні білки - спочатку утворені кількома десятками амінокислот - розбиваються на дипептиди, трипептиди і вільні амінокислоти, всі легко всмоктуються речовини, що надходять з капілярів слизової оболонки кишечника транспортується до печінки.
Трипсин і хімотрипсин у фекаліях
Визначення хімотрипсину і трипсину в фекаліях застосовується, і особливо було в минулому, як непрямий тест на функціональну здатність екзокринної підшлункової залози. Якщо щось не працює належним чином на цьому рівні залози, то логічно очікувати зниженого синтезу трипсину і хімотрипсину, який також буде недостатнім у фекаліях. Тест має хорошу чутливість, але обтяжений реальним ризиком помилкових спрацьовувань і помилкових негативів. Наприклад, використання проносних засобів знижує концентрацію ферментів у фекальному матеріалі, в той час як прийом травних панкреатичних екстрактів (таких як панкреатин) або овочів (наприклад, стебла ананаса, папайї, папаїну та ін.) бромелайн) викликають помилково негативні результати. Також бактеріальна флора кишечника трохи впливає на кількість трипсину і хімотрипсину, які надходять у незміненому вигляді з фекаліями; з цієї причини використання антибіотиків може виробляти помилкові негативи; навпаки, при наявності дивертикульозу та інших станів, що сприяють проліферації бактерій, можуть бути записані хибнопозитивні результати.
Класичним застосуванням дози трипсину і хімотрипсину у фекаліях є виявлення панкреатичної недостатності у хворих на кістозний фіброз. Одним з наслідків цього захворювання є порушення нормального транспорту трипсину та інших травних ферментів від підшлункової залози до дванадцятипалої кишки; з цієї причини, при народженні, фекалії дитини з кістозним фіброзом є особливо компактними, до точки, що викликає непрохідність кишечника. В результаті, в меконії фіксуються особливо невеликі кількості хімотрипсину і трипсину.